Молекулярно‑генетическое тестирование (МГТ) – ключевой инструмент для определения мутаций при злокачественных новообразованиях и выбора таргетной терапии. Несмотря на критическую значимость этого вида исследований для выбора схемы лечения, МГТ в России долгое время проводилось только при поддержке фармкомпаний, заинтересованных в реализации своих препаратов, и за счет самих пациентов. Год назад МГТ получило отдельный норматив финансирования по программе госгарантий, но в большинстве регионов по‑прежнему нет достаточных мощностей для использования даже минимального спектра биомаркеров, а наиболее передовой метод исследования – секвенирование нового поколения (next generation sequencing, NGS) – доступен по ОМС лишь ограниченному кругу московских пациентов. Vademecum оценил потенциал и перспективы МГТ в достижении показателей федерального проекта «Борьба с онкозаболеваниями».
Федеральный онкопроект предполагает дополнительное финансирование лекарственной терапии ЗНО, в том числе таргетной. В 2019-2020 годах система ОМС дополнительно получила на эти цели 185 млрд рублей из федерального бюджета, план на 2021-й – плюс 135 млрд рублей (при совокупных затратах порядка 300 млрд рублей). Перечень ЖНВЛП за последние три года пополнился семью МНН таргетных препаратов, требующих, согласно российской инструкции, предварительного генетического тестирования для определения мутаций в генах. Для офф-лейбл назначения еще как минимум трех препаратов тоже могут проводиться тесты – в соответствии с показаниями, утвержденными FDA.
Появление в клинических рекомендациях и клинико-статистических группах соответствующих схем лекарственной терапии повлекло за собой и необходимость выделения в программе госгарантий в 2020 году норматива финансирования на МГТ «с целью выявления онкологических заболеваний и подбора таргетной терапии», тем более что частота ответа на противоопухолевую терапию, по приблизительным оценкам, составляет 20–80%, то есть часть пациентов стабильно получают препараты, в том числе дорогостоящие, без заметного результата, но с побочными эффектами.




ФИШ С ВАМИ
Наиболее распространенные молекулярные нарушения – соматические (приобретенные) мутации генов EGFR, KRAS, NRAS, BRAF, BRCA1/2 (при этом могут быть наследственными), а также транслокации в генах ALK и ROS1 и экспрессия белка PD-L1. Выявляются они разными по сложности и стоимости исследованиями – ПЦР, секвенированием по Сэнгеру, FISH и самым новым NGS. «Поломки» с помощью МГТ обнаруживаются в опухолевой ткани и крови, что позволяет назначить корректную схему лечения при раке молочной железы, яичников, немелкоклеточном раке легкого (НМРЛ), колоректальном раке, меланоме, раке предстательной железы и ряде других ЗНО.
«Зависимость прямо пропорциональная – чем больше проводится тестов, тем больше выявляется пациентов, которым показана таргетная терапия. Это инструмент персонализации онкологической помощи. Конечно, для определенных нозологий тест обязателен. Кроме того, тестирование уже позволяет определять тактику лечения не только таргетными препаратами, но и, при определенных нозологиях, показания для иммунотерапии. Например, при выявлении экспрессии PD-L1 или наличии микросателлитной нестабильности, знание о которых дает возможность определить показания для иммунотерапии и спрогнозировать эффективность лечения», – говорит исполнительный директор Российского общества клинической онкологии (RUSSCO) Вера Карасева.
Более того, в последнее время в стратегии выбора терапии в некоторых случаях получается группировать опухоли не по нозологическому принципу, а лишь по корректно определенной с помощью МГТ мишени, например, транслокации с участием NTRK. «Опухоли с этой мишенью встречаются в пределах очень многих нозологий, но нигде не концентрируются (для NTRK при большинстве нозологий это 1% или менее от общего числа больных). Но там, где эта мишень есть, она действительно является крайне значимой, подтверждение чему – почти 80-процентная частота объективных ответов в регистрационном исследовании», – отмечал в июле 2020 года руководитель отдела междисциплинарной онкологии НМИЦ ДГОИ им. Дмитрия Рогачева Николай Жуков.
Если учитывать только шесть перечисленных выше нозологий, обеспечить МГТ следует весьма многочисленную группу пациентов. В 2019 году, по данным МНИОИ им. П.А. Герцена, заболеваемость по этим профилям в России достигла 200 тысяч вновь зарегистрированных случаев. В программе госгарантий в 2020 году был обозначен норматив в 0,0007 исследования на одного застрахованного, или 102,4 тысячи в год, в плане на 2021-й этот показатель вырос до 173,2 тысячи исследований. Много это или мало? Едва ли нормативы программы госгарантий можно считать референсными, а наверняка никто не считал.
Пока можно лишь оценить влияние погружения МГТ в систему ОМС. До этого исследования были доступны пациентам либо за их счет – в частных лабораториях, либо по программе RUSSCO «Совершенствование молекулярно-генетической диагностики в РФ с целью повышения эффективности противоопухолевого лечения». С 2011 года при финансовой поддержке фармкомпаний (сейчас в программе участвуют Pfizer, Merck, Amgen, AstraZeneca, Novartis и Roche) было проведено более 100 тысяч тестов. «Задача этого проекта – сделать молекулярно-генетическое тестирование доступным для врачей и больных в любой точке России. Почему это важно? Потому что сегодня наша лечебная тактика может строиться на знании, есть ли у больного та или иная мутация, присутствует ли тот или иной патологический ген. Для продуктов этих патологических генов созданы препараты, которые существенным образом влияют на лечение опухолевого процесса. И если мы не будем проводить молекулярно-генетическое тестирование, мы не «увидим» этих больных, не узнаем, кто из нашей огромной армии пациентов на самом деле нуждается в высокоэффективных таргетных препаратах», – рассказывал Vademecum в 2014 году председатель RUSSCO Сергей Тюляндин.
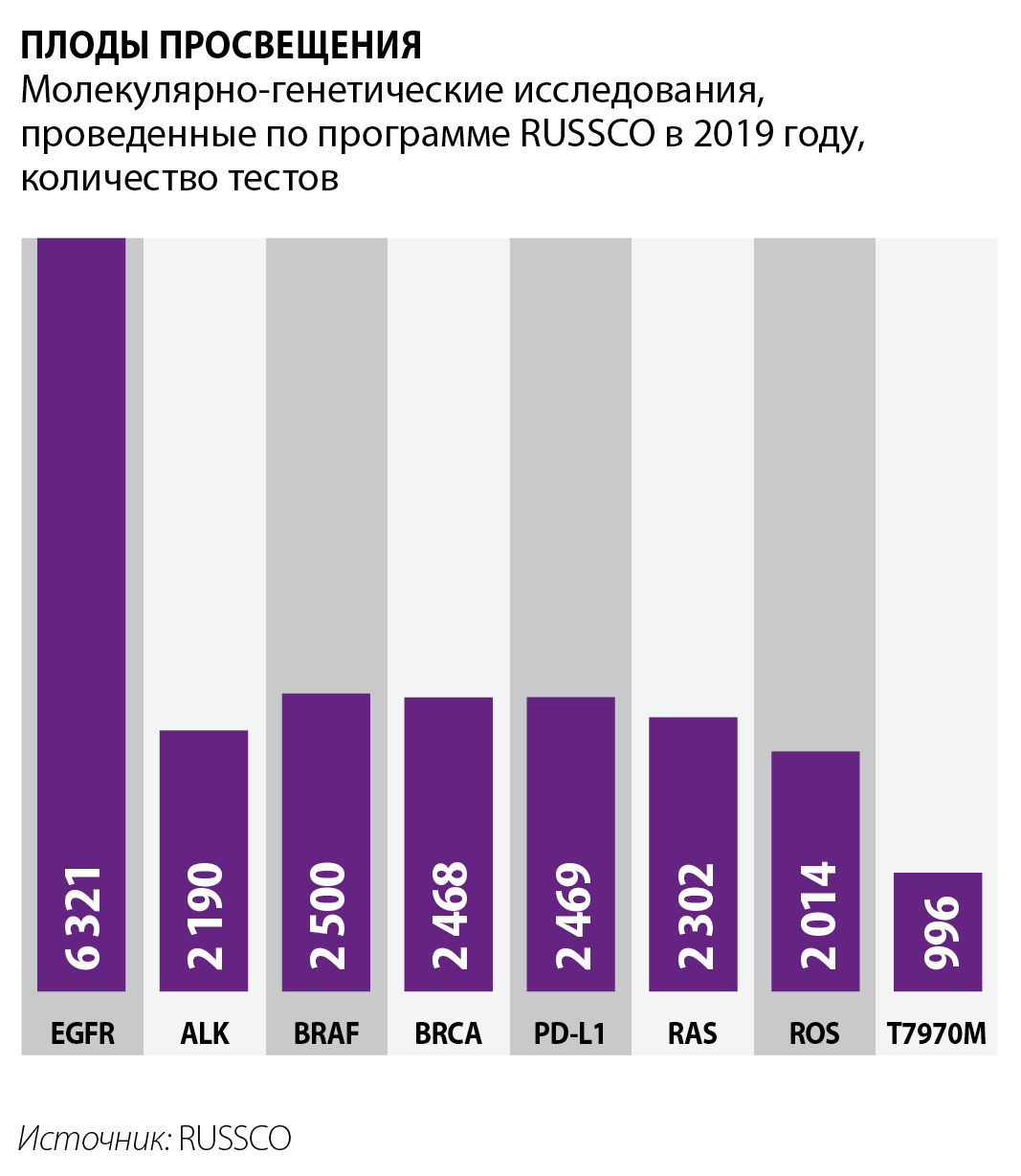
В ФФОМС уточнили, что в 2020 году было проведено 87 тысяч МГТ за счет ОМС. Известно, что в этот период, как оценивал ситуацию фонд, региональные медучреждения стали несколько чаще, чем раньше, назначать таргетные препараты, несмотря на дороговизну схем. Однако оказалось, что данные о назначениях этих лекарств не бьются с количественными объемами проведенных молекулярно-генетических исследований. Начальник Управления модернизации системы ОМС фонда Ольга Царева даже заподозрила, что пациентов вынуждают оплачивать эти тесты самостоятельно. Так ли это, достоверно неизвестно. Но ежегодно в периметре проекта RUSSCO в 36 лабораториях при онкологических медучреждениях проводится порядка 20 тысяч исследований. При этом только в «Инвитро» в 2019 году было выполнено более 6 тысяч онкогенетических исследований, а в 2020-м этот показатель увеличился на 10%. В связи с растущим спросом, несмотря на погружение исследований в ОМС, планируется и далее развивать это направление, отметили в холдинге. В компании «Ситилаб» в год делают до 4 тысяч таких тестов – BRCA, KRAS, EGFR и BRAF, – что, по мнению директора по производству сети Руслана Гулиева, сетующего на неосведомленность профсообщества и низкий платежеспособный спрос, пока «катастрофически мало».
Как отмечают в RUSSCO, почти в половине регионов аналитических мощностей для полного спектра МГТ, необходимого для назначения таргетной терапии, при онкодиспансерах нет. Где-то существующие лаборатории выполняют только часть исследований на две-три мутации, а остальные случаи направляют в крупные центры – с «межтерами» по этому направлению сталкиваются только в Москве и Санкт-Петербурге, хотя есть и региональные исключения – например, Томский НИМЦ принимает биоматериал из нескольких сибирских регионов. «Практически все молекулярно-генетические лаборатории начали работать по ОМС, но большинство из них делают тесты только для своего региона. В связи с появлением тарифа они начали набирать мощность и расширять спектр мутаций – в среднем по стране это уже приблизительно четыре – шесть, а не два-три, как раньше. Другая проблема – финансы, для тестов нужны реагенты, на них зачастую выделяется ограниченный объем денег», – поясняет Вера Карасева.
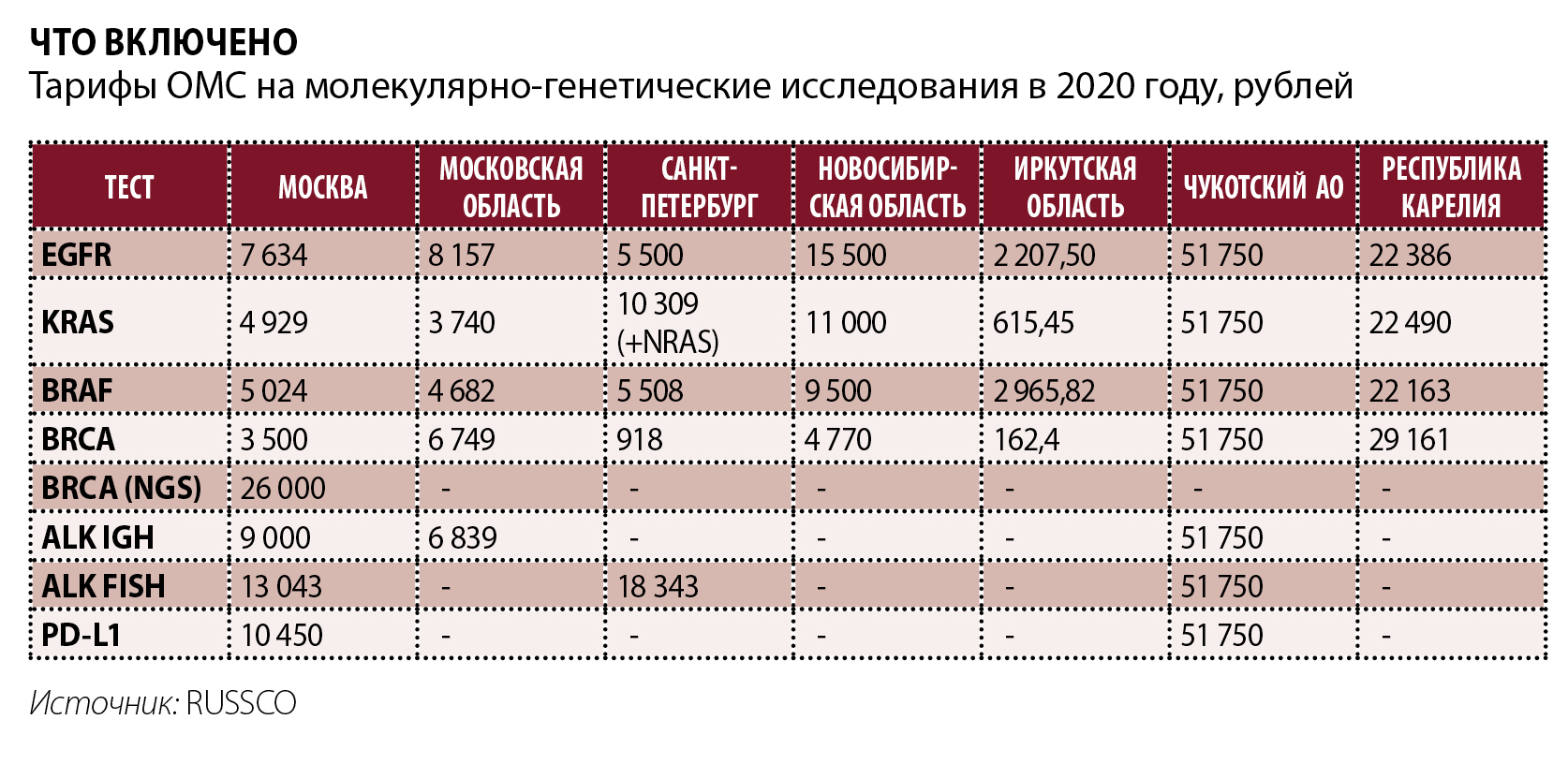
Тарифы на МГТ, как водится, от региона к региону разнятся. Это первое. И второе – ОМС не везде покрывает расходы на логистику биоматериала в другие лаборатории. Эту часть затрат с 2021 года предложили обеспечивать RUSSCO и несколько медорганизаций – НМИЦ радиологии, НМИЦ онкологии им. Н.Н. Блохина, МКНЦ им. А.С. Логинова, Томский НИМЦ, Курский областной клинический онкодиспансер, в Санкт-Петербурге – МИБС.
ЦЕЛЕЙ ПОЛАГАНИЕ
«Было мнение, что хватит и одной-двух крупных лабораторий для охвата всех пациентов в стране, однако спектр показаний для молекулярно-генетического тестирования расширяется и растет число тестов, что требует усиления инфраструктуры. С другой стороны, в регионах с небольшой численностью населения организация подобной лаборатории может оказаться нерентабельной, – рассуждает Вера Карасева. – Например, набор реагентов рассчитан на 20 исследований, значит, надо ждать, когда наберется группа из 20 пациентов. Время уйдет. Кроме того, остро стоит вопрос подготовки кадров – врачей-генетиков. Поэтому в количестве лабораторий нужно искать баланс».
Так или иначе, но первый год присутствия МГТ в ОМС значительного расширения профильной инфраструктуры в регионах не спровоцировал. Возможно, в связи с пандемией, а может быть, из-за понимания ограниченности бюджета на закупку таргетных препаратов. Четыре добавленных в 2019 году в ЖНВЛП препарата (требующих, по российской инструкции, МГТ) регионы совокупно приобрели на 3,6 млрд рублей. Для сравнения: одного бевацизумаба или пембролизумаба было закуплено на большую сумму (3,9 млрд и 3,7 млрд рублей соответственно). Всего же в 2019 году онкопрепараты были приобретены на 106,7 млрд рублей.

Но некоторые примеры организации МГТ-мощностей все же найдутся. Молекулярно-генетический отдел в 2020 году появился при клинико-цитологической лаборатории Тамбовского областного онкологического клинического диспансера. В Москве расширение молекулярно-генетической диагностики происходит параллельно с реорганизацией городской онкологической службы – в составе шести патоморфологических лабораторий. На их модернизацию городской бюджет направил не менее 670 млн рублей. Мотивация понятна – в столице отдельно финансируются закупки таргетных препаратов по шести нозологиям, соответственно, есть смысл инвестировать и в тестирование.
По той же причине в 2020 году в Москве впервые начали оплачивать и новый вид генетических исследований – NGS, или высокопроизводительное (массовое параллельное) секвенирование нового поколения. Метод позволяет как секвенировать весь геном, так и использовать панели, ориентированные на конкретные мутации, включая редкие. Именно поэтому NGS сегодня находится на стыке науки и клинической практики. Высокая чувствительность позволяет искать мутации не только в тканях, но и в свободно циркулирующей в плазме крови опухолевой ДНК (цоДНК).
Например, летом 2020 года Управление по контролю за продуктами и лекарствами США (FDA) одобрило тест для жидкостной биопсии Liquid CDx производства компании Foundation Medicine (принадлежит Roche). Панель позволяет проанализировать на наличие мутаций 324 гена для всех солидных опухолей, но главным образом для диагностики НМРЛ и метастатического кастрационно-резистентного рака предстательной железы. Речь идет о мутациях, знание о которых в случае с НМРЛ позволяет назначить лечение ингибиторами тирозинкиназы, а при метастатическом кастрационно-резистентном раке предстательной железы – одобренным FDA только в мае 2020 года ингибитором PARP Rubraca (рукапариб) от Clovis Oncology. Стоимость МГ-тестирования (за счет страховых программ) оценивается в $5,8 тысячи.
«Сегодня продвинутые онкологи назначают, скажем, тестирование на мутацию в BRCA. И вот наличие мутации должно подсказать, какое лекарство назначить. При этом спектр мутаций может быть весьма широким. И если, допустим, 10 мутаций покрывают 80% случаев рака, то оставшиеся 20% могут выдать еще 100 мутаций. Методом ПЦР это технически очень сложно проверить, ПЦР смотрит в одну точку, но зато это дешево. NGS позволяет проверить тысячи мутаций, фактически все гены в опухолевой ткани. По спектру мутаций можно классифицировать тип опухоли, что дополнительно подтверждает диагноз, поставленный на основании гистологического исследования биоптата. Одна-две мутации – это здорово, они закрывают какие-то классы, но очевидно, что чем больше мутаций, тем более точно ты можешь определить лекарство», – говорит соучредитель компании «Геноаналитика», заведующий лабораторией геномики и эпигеномики позвоночных ФИЦ «Фундаментальные основы биотехнологии» РАН Егор Прохорчук.
С ним согласна Вера Карасева из RUSSCO: «Классический пример – немелкоклеточный рак легкого, требующий выполнения тестирования нескольких мутаций. Стандартными методами они определяются последовательно: одну нашли – хорошо, значит, пациент идет на терапию. Если нет, то ищем вторую. И так далее – EGFR, ALK, ROS1, а далее определение PD-L1. Также в практику постепенно входит определение редких мутаций, таких как BRAF, RET и других. Пациент вынужден ждать, а ведь метастатические формы рака могут прогрессировать быстро. NGS позволяет протестировать сразу несколько мутаций. Исследование, на первый взгляд, покажется дороже других, но на самом деле стоить будет столько же, сколько потребуется, если суммировать все необходимые тесты. Но мы выиграем время, что бесценно для пациента».
ПАНЕЛЬНАЯ НАДСТРОЙКА
В России первым зарегистрированным NGS-тестом стал «Соло-тест ABC» от «ОнкоАтласа», ориентированный на выявление мутаций в генах BRCA1/2, ATM и CHEK2. С июля прошлого года расширенное исследование проводится в Москве по ОМС с тарифом 26 тысяч рублей. Пока оно охватывает только пациенток старше 45 лет с РМЖ, а также больных с раком яичников, поджелудочной железы и простаты. Врачебное сообщество предлагало распространить исследование и на здоровых родственников пациентов, у которых обнаружена мутация, но сделать это не удалось, пояснила на вебинаре, проводившемся ассоциацией «Здравствуй», заведующая молекулярно-биологической лабораторией МГОБ №62 Ирина Демидова.
По словам директора научного центра «ОнкоАтлас» Владислава Милейко, во время регистрации «Соло-тест ABC» компания столкнулась с фундаментальной проблемой, осложняющей выход подобных панелей на российский рынок. «Оказалось, что представление о медицинском изделии в России фундаментально отстает от возможностей современной генетической диагностики. Считается, что одно МИ может исследовать один аналит – мутацию, и для каждого из них нужно провести КИ, доказать, что все работает. Но NGS предполагает анализ тысячи мутаций, более того, не все из них нам известны заранее, а некоторые встречаются крайне редко. У нас и у экспертных институтов Росздравнадзора ушло очень много времени, чтобы эти концепции друг с другом примирить», – делится трудным опытом Милейко.
Планируют в «ОнкоАтласе» тиражировать эту практику и в других регионах, несмотря на неоднородную тарифную политику.
«Мы посмотрели тарифы по тестированию BRCA1/2. Про NGS в тарифных соглашениях, разумеется, нет ни слова, но есть порядка 15 регионов, где тариф на анализ BRCA уже больше московского. То есть мы могли бы уже сегодня обеспечить пациентов из этих регионов современной NGS-диагностикой вместо малоинформативного ПЦР-теста, себестоимость которого – 1 500 рублей. Все зависит от готовности региональных властей и врачей к подобной работе», – говорит Владислав Милейко.
На платной основе NGS проводится и в других лабораториях, где установлены секвенаторы, – это и государственные учреждения, и частные компании, например, «Геноаналитика», «Геномед», Genetico. Расценки зависят от широты панелей и стартуют от 30 тысяч рублей. Продают российские операторы и услуги уже упомянутой Foundation Medicine, включая жидкостную биопсию, однако биоматериал направляется на секвенирование в Германию или США.
«Врачи зачастую недостаточно информированы, поэтому пока не готовы полноценно использовать метод NGS. Кроме того, они обязаны следовать национальным клиническим стандартам лечения. В зарубежных клинических рекомендациях, например, рекомендациях NCCN (National Comprehensive Cancer Network), в некоторых случаях уже рекомендовано активно применять панели на основе секвенирования (например, при раке легкого). В наших же клинических рекомендациях пока упоминается лишь несколько генов, которые прекрасно можно посмотреть с помощью ПЦР, FISH или секвенирования по Сэнгеру, хотя в каких-то случаях, действительно, NGS и проще, и выгоднее. Есть небольшое количество врачей, в основном из коммерческих медцентров, которые знают об этом и готовы обращаться к этому инструменту, но тут существует еще одно ограничение – в виде платежеспособности пациентов», – объясняет конъюнктуру заведующая лабораторией онкогенетики компании Genetico Дарья Хмелькова.
Если оставить финансирование за скобками, главным из условий для более широкого внедрения NGS в клиническую практику остается готовность врачей к использованию методики и ее применимость. «Врач должен, во-первых, иметь специальную подготовку, а также некую базу данных для того, чтобы принимать решение. Если есть сомнения, он может назначить сиквенс. На выходе из лаборатории должен быть спектр мутаций, которые можно загрузить в специальную базу данных и получить рекомендации лекарственных назначений или хотя бы сведения об аналогичных клинических случаях со схемой лечения и исходами. Будущее таких алгоритмов принятия решения лежит в области применения систем искусственного интеллекта и анализа больших данных», – считает Егор Прохорчук.
Еще одно направление, требующее генетических исследований, в том числе и NGS, – популяционный скрининг, например, на РМЖ. Согласно методическим рекомендациям, к значимым факторам риска относятся пациентки не только с установленными генетическими мутациями, например BRCA, но и имеющие среди родственников первой степени родства случаи ЗНО яичников, молочной железы, поджелудочной железы. Генетические мутации, выявляемые с помощью BRCA-теста, встречаются, по разным оценкам, у 5–15% женщин, а вероятность заболеть РМЖ в этой когорте колеблется в диапазоне 60–80%. Несмотря на это и на цели нацпроекта по раннему выявлению ЗНО, в Порядок проведения профосмотра и диспансеризации (приказ Минздрава РФ №124н от 13 марта 2019 года) тест не входит – попытки вовремя обнаружить РМЖ в «Перечне мероприятий скрининга и методов исследований, направленных на раннее выявление онкологических заболеваний» ограничиваются маммографией обеих молочных желез среди женщин в возрасте от 40 до 75 лет.
При этом, согласно вышедшему в 2020 году исследованию международной группы ученых «Экономическая оценка популяционного тестирования мутаций BRCA1/2», в странах с высоким и средним доходом экономически эффективно тестировать всех женщин старше 30 лет, даже без анамнеза в семье, и уже для носителей мутации – проводить ежегодную маммографию и МРТ. В то же время остается открытым вопрос применимости всех данных, полученных с помощью NGS. «Огромное количество совершенно лишней информации, которая не может быть использована для таргетной терапии, так как препаратов еще нет. Зачастую обнаруживаются очень редкие генетические мутации, по которым непонятно, будет ли на них работать таргетный препарат. Вполне возможно, что нет», – резюмирует Ирина Демидова из МГОБ №62.






