Речь идет о самом дорогом в мире и пока не зарегистрированном в РФ препарате Золгенсма, способном, по данным производителей и одобривших его применение национальных регуляторов, переломить течение спинальной мышечной атрофии (СМА) с помощью одной инъекции. О том, какой путь проделали разработчики революционной терапии, чтобы вывести препарат на мировой рынок, и каковы перспективы Золгенсмы в России, разбирался Vademecum.
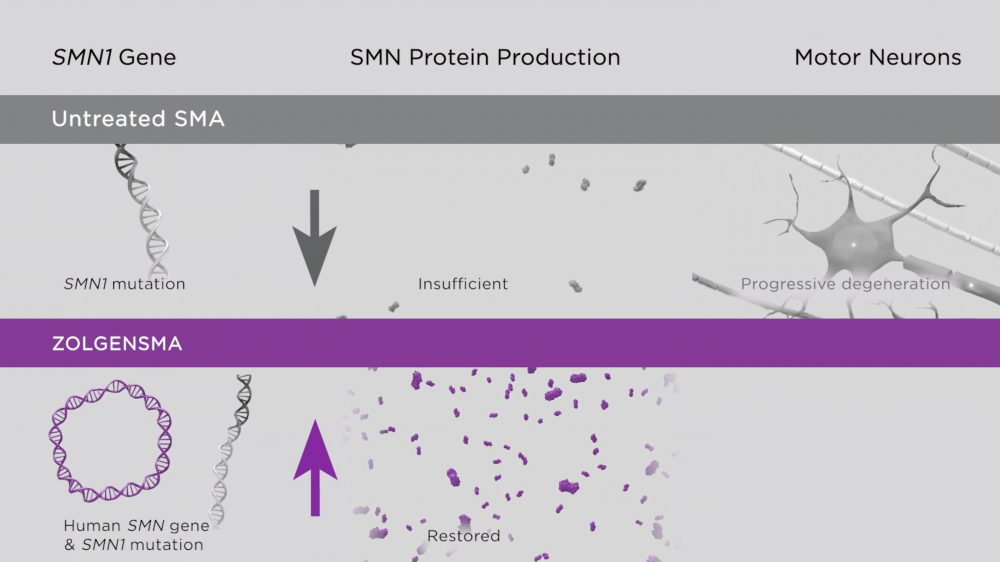
Золгенсма (онасемноген абепарвовек) стал третьим из существующих сегодня в мире препаратов для патогенетической терапии СМА – наследственного нервно-мышечного заболевания, не позволяющего без лечения дожить до двух лет половине пациентов со СМА первого типа. Распространенность этого младенческого типа СМА – один случай на 6–10 тысяч новорожденных.
Препараты патогенетической терапии СМА применяются в мире с 2016 года, до этого момента лечение было симптоматическим. Первые два – Спинраза (нусинерсен от Biogen) и Эврисди (рисдиплам от Roche) – уже зарегистрированы в России, досье на третий – генотерапевтический препарат Золгенсма – подано на регистрацию в 2020 году. Терапия ожидающего одобрения Минздравом РФ средства предусматривает однократное внутривенное введение, тогда как два других препарата принимаются пожизненно.
Разработкой Золгенсмы занималась группа американских ученых под руководством доктора Брайна Каспара, практиковавшего в Университете Огайо, а затем – в Научно-исследовательском институте Национальной детской больницы. На фоне успешных доклинических испытаний препарата FDA в сентябре 2013 года одобрило заявку (investigational new drug application) разработчиков на проведение КИ. Спустя месяц препарат получил статус fast track, дающий доступ к ускоренному одобрению регулятором. Эксклюзивные права на генную терапию СМА были приобретены компанией BioLife, в начале 2014 года реструктурированной и переименованной в AveXis.
Тогда же разработка доктора Каспара и Ко получила статус орфанного препарата.
Клиническое исследование Золгенсмы I фазы START началось в мае 2014 года на базе Национальной детской больницы на 15 детях со СМА 1-го типа в возрасте до шести месяцев. За успешным START последовали другие КИ – в США и Европе.
На начальных этапах разработка финансировалась за счет различных грантов и донаций благотворителей. После выхода на сцену BioLife/AveXis и обнадеживающих решений регулятора в проект начали вкладываться венчурные фонды: в 2015 году разработчики получили на проведение КИ Золгенсмы $10 млн от Deerfield Management и Roche Venture Fund, а затем – от ряда инвесткомпаний – еще $65 млн.
В феврале 2016 года AveXis с помощью IPO привлекла $98,2 млн, однако и этот год, и следующий закончила с убытком. В 2018 году о покупке AveXis за $8,7 млрд объявила швейцарская Novartis. К тому времени уже были известны позитивные результаты START, а AveXis готовилась подать заявку в FDA на одобрение Золгенсмы.
В мае 2019 года национальный регулятор одобрил использование препарата для лечения детей со СМА I типа. Золгенсма стала первой в мире генной терапией, разрешенной к применению у детей до двух лет.
Впрочем, без накладок не обошлось. Через месяц после регистрации AveXis сообщила FDA о вскрывшемся факте манипулирования данными доклинического исследования препарата.
FDA, убедившись, что спорная часть исследований не влияет на полученные в КИ показатели безопасности и эффективности, а относится к особенностям производственного процесса, регистрацию отзывать не стало. Тем не менее итогом проведенного в AveXis внутреннего расследования стало увольнение «отца» Золгенсмы – доктора Брайана Каспара, занимавшего на тот момент позицию главного научного сотрудника компании, и его брата Аллана Каспара, старшего вице-президента AveXis по исследованиям и разработкам.
В мае 2020 года Золгенсма получила одобрение ЕМА, а следом – национальных регуляторов Японии, Канады и ряда других стран.
Оригинатор, объявивший цену на Золгенсму в США на уровне $2,1 млн за флакон, поставил мировой рекорд – препарат стал самым дорогим на глобальном фармрынке лекарством. Но и эта беспрецедентная цена, как выяснилось, была для Novartis, изначально нацеливавшейся на планку в $5 млн, компромиссом, поскольку страховые компании были готовы покрыть любую стоимость инновационного препарата, сообщал президент Бостонского института клинико-экономической экспертизы (ICER) Стивен Пирсон.
Правообладатели удовлетворились предельным в ценовых расчетах ICER уровнем в $2,1 млн, и применение верхней границы диапазона вполне оправдано, считает Пирсон: «Золгенсма кардинально меняет жизни семей, столкнувшихся с этим разрушительным заболеванием, тем более с учетом новых данных об эффективности препарата для пациентов до проявления симптомов».
Подобная оценка может считаться адекватной лишь с тем условием, что после единственного укола Золгенсмы продолжения терапии не требуется. А как раз этот вопрос пока остается открытым: долгосрочное пострегистрационное исследование препарата на пациентах, участвовавших в START, продолжается, и по состоянию на июнь 2020 года семь из тринадцати участников КИ дополнительно получали нусинерсен.
В июле 2020 года компания Biogen – оригинатор Спинразы – анонсировала новое КИ RESPOND, призванное оценить клинические преимущества и безопасность применения Спинразы в терапии детей со СМА, получивших Золгенсму. В начале 2021 года начался набор пациентов. А ведь именно форма и однократность введения («один укол спасает жизнь») – главный козырь генотерапевтического препарата от AveXis.
В январе 2020 года AveXis запустила программу управляемого доступа к генной терапии СМА, заявив, что в течение года бесплатно передаст до ста доз препарата для пациентов из стран, где Золгенсма пока не одобрена. Получателей определяет «лотерея», для участия в которой претенденту необходимо иметь рекомендацию от врача по применению Золгенсмы и доказательство того, что пациент не получает терапию другими лекарствами. «Розыгрыши» проводятся каждые две недели, «победитель» определяется вслепую, «проигравшие» продолжают участие в следующих «раундах». В 2021 году оригинатор таким же методом распределит еще 100 бесплатных доз препарата.
В России в реестр фонда «Семьи СМА» внесены данные почти 1 тысячи пациентов, при этом терапию Золгенсмой получил 41 ребенок, в том числе 19 детей, участвовавших в программе управляемого доступа. Еще четверо российских пациентов готовятся к получению лечения в мае-июне 2021 года, сообщили Vademecum в Novartis. Двое детей участвовали в клинических исследованиях Золгенсмы за рубежом, уточнила Vademecum директор фонда «Семьи СМА» Ольга Германенко, остальные получали препараты, закупленные родителями на собственные средства или за счет благотворителей.
Первое время после одобрения Золгенсмы за рубежом российских детей для получения терапии вывозили за границу. Сейчас инъекции препаратом, поступающим в Россию по специальному регламенту для конкретных пациентов по жизненным показаниям, осуществляются в четырех федеральных и двух региональных медцентрах.
Прежде чем начинать терапию Золгенсмой, пациенту необходимо сделать тест на антитела к AAV9/или/используемому аденоассоциированному вирусу (если таковые обнаружатся, препарат использовать нельзя), а такое исследование проводят всего две лаборатории – в США и Голландии, объясняет Германенко, берущаяся же для анализа кровь относится к биоматериалам, вывозить которые за границу может только лицензированная организация, получив специальное разрешение.
По словам главы фонда «Семьи СМА», в случаях с участниками «лотереи» управляемого доступа все расходы по тестированию и обеспечению логистики брала на себя Novartis. Как эти проблемы будут решать инициаторы новых орфанных проектов, пока непонятно.
Тем не менее Золгенсма может стать первым не зарегистрированным в РФ препаратом, который будет закупаться государственным внебюджетным фондом «Круг добра» (в основном финансируется за счет увеличения ставки НДФЛ для резидентов, зарабатывающих более 5 млн рублей в год). Председатель правления фонда Александр Ткаченко пообещал, что к концу 2021 года все дети со СМА будут обеспечены лекарственной терапией. Спинраза и Эврисди на аккумулированные «Кругом добра» 9,7 млрд рублей уже закуплены специальной структурой Минздрава, а не зарегистрированные в РФ препараты фонд должен будет приобретать самостоятельно.
Ткаченко говорил, что закупку Золгенсмы тормозит лишь отсутствие регламентов в отношении ввоза не зарегистрированных в РФ лекарств. Но в мае 2021 года был утвержден порядок лекобеспечения такими препаратами. Он предусматривает, что закупаться могут препараты, не зарегистрированные в РФ, но получившие одобрение FDA и EMA.
Кроме того, возможна оплата за счет средств фонда лечения за рубежом, включая покрытие расходов на транспорт и проживание. Что же касается тестирования пациентов на антитела, то такая задача, по словам Ткаченко, перед фондом не стоит, эти вопросы должен решать лечащий врач ребенка.
Золгенсма производится на единственной в мире площадке, расположенной в американском штате Иллинойс. Novartis готова организовать доставку препарата в Россию в срок до двух недель с момента получения запроса при наличии готового разрешения на ввоз от Минздрава РФ, сообщили в компании. Производственные возможности Novartis позволяют обеспечить терапией всех нуждающихся в ней российских пациентов. Но поскольку препарат не зарегистрирован в РФ, закупать его придется по цене, установленной производителем в США, то есть по $2,1 млн за флакон. «Мы готовы к диалогу с регулирующими органами для установления в будущем оптимальной стоимости терапии для российских пациентов в рамках государственных программ финансирования, а также к применению инновационных моделей лекарственного финансирования, таких как софинансирование или отсрочка платежа», – уточнили в компании.
Заминка в закупке генотерапевтического препарата от СМА наверняка связана еще и с тем, что первый выделенный фонду транш – 10 млрд рублей – практически исчерпан, хотя всего в 2021 году «Круг добра» только за счет изменения налоговой шкалы должен получить 60 млрд. Ну а кроме того, фонд, наряду со СМА, нацелен еще на ряд нозологических направлений и помощь орфанным пациентам, нуждающимся в дорогостоящем лечении.
Глобальная фарминдустрия, предложившая врачам и пациентам три патогенетических средства для терапии СМА, продолжает разрабатывать направление.
С 2015 года клинические испытания на детях со СМА 1-го типа проходил branaplam (NVX-101) от Novartis. Препарат имеет схожий с рисдипламом механизм действия и тоже применяется перорально. В мае 2016 года у животных, получавших препарат, наблюдались тяжелые побочные эффекты, и Novartis решила остановить набор пациентов для клиники, но уже через год возобновила формирование когорты испытуемых. И все же в конце 2019 года президент Института биомедицинских исследований Novartis Джей Брэднер заявил, что компания приостанавливает КИ, поскольку не видит перспективы в пероральной терапии СМА, однако branaplam будет исследоваться для других показаний.
В России созданием генотерапевтического препарата для терапии СМА с 2018 года занимается «Биокад». В марте 2021 года в компании сообщили о завершении раннего этапа разработки молекулы ANB-4. В «Биокаде» рассчитывают на ускоренную регистрацию препарата, если этот прогноз сбудется, продукт может появиться на рынке уже через 3–5 лет.