Колоректальный рак, ежегодно уносящий жизни более 18 тысяч россиян, относится к онкозаболеваниям, которые можно не только успешно диагностировать и лечить, но и в принципе не допускать. Врачам известны факторы риска, способы предотвращения болезни, сценарии скрининговых программ, методы лечения. Одним словом, что делать – понятно, вопрос в том, когда у отечественной индустрии здравоохранения появится возможность применить мировой клинический опыт в масштабах нашей страны, где колоректальный рак входит в тройку наиболее распространенных онкозаболеваний.
На долю рака кишечника приходится чуть больше 13% всех случаев онкозаболеваний в России, что выводит его на третью позицию в национальном канцер-регистре: по частоте выявляемости у мужчин он уступает только раку легкого (17,8%) и раку предстательной железы (14,4%), у женщин – раку молочной железы (20,9%) и кожи (14,6%, без учета меланомы). В декабре 2016 года на учете в онкодиспансерах состояло 202 517 пациентов со злокачественными новообразованиями ободочной кишки и 154 533 – с опухолью прямой кишки. В прошлом году онкологи диагностировали 34 293 новых случая злокачественных новообразований ободочной кишки, притом что десятью годами ранее, в 2006-м, был выявлен лишь 12 331 случай. Похожий расклад с опухолями прямой кишки: в 2016 году – 25 98 диагноза, в 2006-м – 11 613 случаев. Кратный рост заболеваемости отчасти объясняется лучшей выявляемостью – онкологи и эндоскописты научились диагностировать рак кишечника, в том числе врачи стали чаще обнаруживать наследуемые формы колоректального рака. «Если раньше считали, что частота наследуемых раков маленькая, то с 2015 года в Америке все новые случаи рака прямой и толстой кишки проверяют на наследуемую форму. Это реально другая вселенная. Но в России это пока не распространено», – признает руководитель центра хирургии GMS Clinic Бадма Башанкаев. Но на реальный рост заболеваемости, говорят специалисты, в куда большей степени влияют внешние факторы – высококалорийная и бедная клетчаткой пища, низкая физическая активность. «Колоректальный рак напрямую связан с так называемым западным образом жизни, с ожирением. Высокое потребление мясных субпродуктов и красного мяса, вред которого у нас не воспринимают всерьез, курение и алкоголь, время, которое человек проводит в сидячем положении, – все это факторы риска. Но эта информация мало доходит до общественности», – замечает научный сотрудник НИИ онкологии им. Н.Н. Петрова и Университета Тампере (Финляндия) Антон Барчук. И хотя колоректальный рак действительно планетарная проблема – по данным Globacon, это заболевание занимает третье место по количеству вновь поставленных онкодиагнозов во всем мире, – есть возможность ее решать и даже предотвращать. И не только с помощью первичной профилактики, но и благодаря запуску скрининговых программ. «Можно находить ранние раки и лечить их. Но основная идея скрининга колоректального рака – находить не только ранние раки и снижать таким образом смертность, а находить ранние предраки и снижать заболеваемость», – поясняет Барчук.Запуску национальных скрининговых проектов международное медицинское сообщество давно и единогласно говорит «да», а вот при практической реализации программ существуют разночтения.
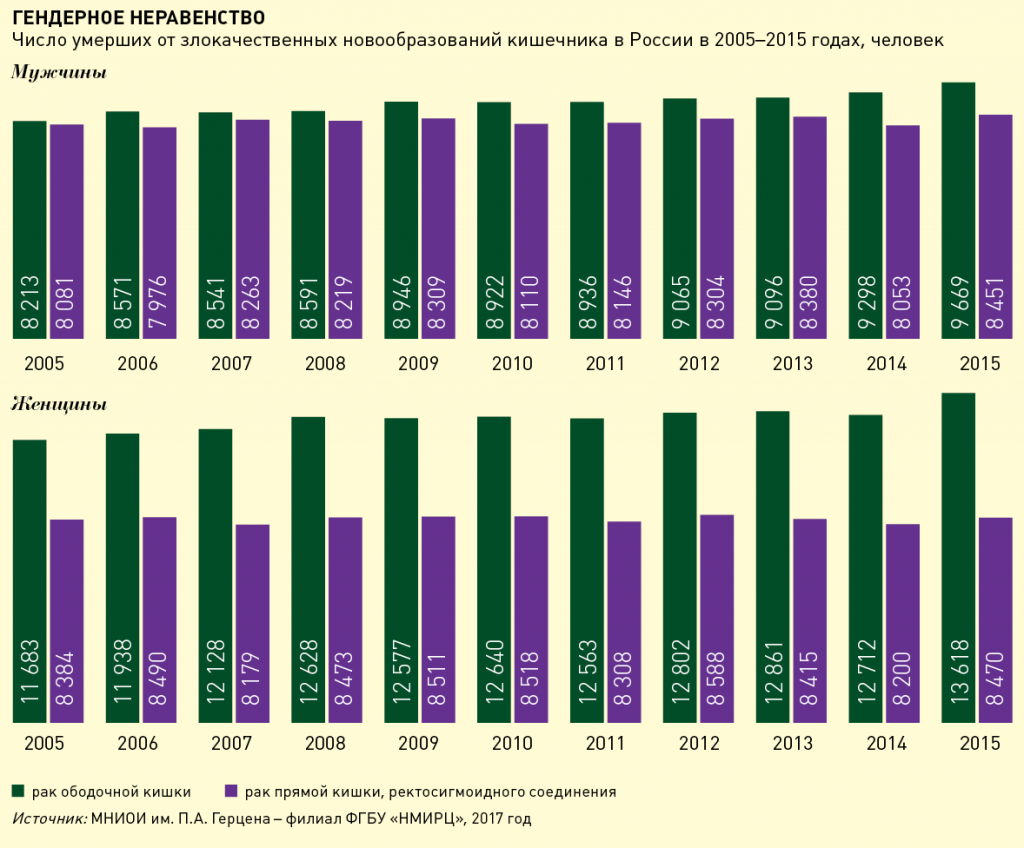
Число умерших от злокачественных новообразований кишечника в России за последние 10 лет
Смертность от злокачественных новообразований кишечника в России
СКРИНИНГ ПО СУСЕКАМ
Условно можно выделить два принципиально отличных подхода к скринингу рака кишечника – американский, стартующий сразу с инвазивной процедуры – колоноскопии, и европейский, предусматривающий выполнение колоноскопии только после положительного теста на скрытую кровь в кале.
«Можно считать, что колоноскопия – это стандартный американский подход, хотя эта процедура и не указана в качестве единственного метода скрининга. В системе медобеспечения ветеранов, например, начинают с тестов на скрытую кровь. А в Нью-Йорке точно делают скрининг с колоноскопией, там достаточно эндоскопистов», – поясняет профессор Латвийского университета, гастроэнтеролог Центра заболеваний органов пищеварения Gastro Марцис Лея. Единственным европейским государством, следующим по пути США, стала Польша: в 2000 году там начали проводить скрининг с акцентом на колоноскопию – национальная система здравоохранения гарантирует гражданам проведение одного инвазивного обследования каждые 10 лет. К 2014 году количество таких процедур выросло в четыре раза, в эндоскопических отделениях (на тот момент их насчитывалось 90, а в ближайшие годы должно стать 130) был внедрен контроль качества диагностики и создана единая информационная база. Сейчас поляки запустили рандомизированное исследование, изучающее колоноскопию в качестве единственного метода скрининга. Его завершения с интересом ожидает научное сообщество, поскольку в опубликованных до сегодняшнего дня работах колоноскопия всегда фигурировала в качестве завершающего этапа исследования.
Большинство же европейских стран используют тесты на скрытую кровь, причем переходят на иммунохимические системы и обработку данных в централизованных крупных лабораториях.
«В северных европейских странах практикуют прагматический подход – они используют только методы с доказанным положительным влиянием на смертность. Американские исследования, проведенные перед внедрением колоноскопического скрининга, этим принципам не соответствовали. И они не признают американские результаты, требуя дополнительных рандомизированных исследований, – рассказывает Марцис Лея. –В мире сейчас ведутся три таких исследования: инициированное норвежцами Nordic и еще два – в Испании и США. Но ждать результатов нам еще минимум пять – семь лет». Флагманом следования скрининговому сценарию, начинающемуся тестом на скрытую кровь, выступили Нидерланды: там тщательно просчитывали и планировали программу, но, едва начав ее реализацию, столкнулись с проблемой – положительных тестов оказалось слишком много, на колоноскопию выстраивались очереди, эндоскописты не справлялись с нагрузкой. Голландцы вынуждены были приостановить программу, чтобы скорректировать концепцию. «Они сработали очень профессионально – поменяли диагностический порог (cut-off), что было возможно с используемыми ими тестами, – поясняет Лея, – и быстро уладили проблему».
Главная цель теста на скрытую кровь – выявление онкозаболевания, но вызывать кровотечение могут и другие воспалительные заболевания кишечника, часть тестов просто оказываются ложноположительными. По оценкам экспертов, примерно у 30–50% обследуемых не будет найдено патологии, еще у 25% затем обнаружат аденоматозные полипы, у 2–5% окажется рак. «У тестов нет четкого cut-off. Колоноскопия, конечно, более точный метод, но человек без жалоб гораздо охотнее пройдет тест, чем инвазивную процедуру, – рассуждает Марцис Лея. – А вот если тест оказывается положительным – ситуация меняется, у человека появляется мотивация».
Несколько иным путем пошли британцы. В Соединенном Королевстве программу скрининга планировали долго и обстоятельно: пилотные проекты сначала запустили только в двух регионах, охватив всего 1 млн жителей. В качестве первичного метода также был выбран тест на скрытую кровь. Согласно общемировым рекомендациям, скрининг показан для возрастной группы 50–69 лет, но британцы сузили диапазон до 60–69 лет. Учитывая ограниченность финансовых ресурсов системы здравоохранения, авторы программы выбрали группу, в которой фиксируется максимальная заболеваемость. «Поначалу у них тоже выстраивались огромные очереди на последующее инвазивное обследование – до года ожидания. Они оптимизировали работу, внедрили контроль качества, многие манипуляции стали делать медсестры, и сейчас система отстроена», – утверждает Антон Барчук. Такую же высокую оценку дает Марцис Лея, добавляя, что сейчас британские операторы скрининговых программ не только увеличивают охват популяции, но и начинают применять комбинацию методов: в случае положительного результата теста на скрытую кровь пациента сначала направляют на сигмоскопию («урезанный» вариант колоноскопии, при котором исследуется не вся толстая кишка, а только нижние отделы).
«В Латвии, как и в Чехии, тесты на скрытую кровь пытаются распространять среди населения через семейных врачей, они же занимаются их обработкой. .Десять лет назад казалось, что это может дать очень хорошие результаты. Теперь мы знаем, что это не лучший подход», – говорит Лея.
Отклик из целевой группы составляет всего 10%, в то время как рекомендованный ЕС минимальный порог охвата – 45%. Программа оказалась неэффективной по нескольким причинам.
Во-первых, многие жители страны годами не посещают семейных врачей. Во-вторых, и сами семейные врачи не хотят заниматься этой работой, а рассчитывать на качественный результат при таком настрое не приходится. В-третьих, вероятность ошибки в используемой схеме очень высока – положительные результаты могут попадать к специалистам раз в год. И потому в 2011 году в Латвии запустили новый пробный шар, нацеленный на определение оптимальной скрининговой модели. Для этого проекта были случайным образом отобраны 15 тысяч человек в возрасте от 50 до 74 лет и поделены на три группы: одна получила тесты на скрытую кровь старого образца, остальные – современные иммунохимические тесты двух видов. Тесты рассылались по почте вместе с уже оплаченным конвертом для отправки выполненных тестов в лабораторию. Кроме этого, половине участников было предварительно направлено письмо-уведомление с краткой информацией о колоректальном раке и значении скрининга. Все, кто не выслал выполненные тесты, получили письмо-напоминание (независимо от того, получали ли они предварительно письмо-уведомление). Если тест оказывался положительным, также по почте людям высылали приглашение на колоноскопию. В этот момент к диагностике подключался и семейный врач, получавший соответствующий тревожный сигнал о подопечном пациенте. Иммунохимические тесты позволили достичь отклика в 45% и 47% случаев, тесты старого образца (gFOBT) – в 31%. «gFOBT намного дешевле иммунохимического теста, но в результате применение иммунохимических тестов экономически выигрышнее, – утверждает Марцис Лея. – Их гораздо легче выполнить пациентам, соответственно, больший охват популяции, требуется меньше рабочей силы для их обработки, и сами исследования можно централизовать». Больший отклик «пилот» получил в сельских районах, а вот разницы между столицей и другими крупными городами не было. При этом отправка писем-напоминаний имела решающее значение для успеха проекта: в общей сложности 31% тестов были получены после разосланного напоминания. Поэтому в условиях ограниченных бюджетов систем здравоохранения авторы исследования советуют организаторам здравоохранения сфокусироваться на отправке напоминаний, а не предварительных уведомлений. Организаторы проекта рекомендовали Минздраву страны принципиально изменить систему скрининга, однако пока в Латвии сохраняется схема работы с семейными врачами.
Учитывая разницу в подходах и возможностях государств, но понимая при этом необходимость онкологических скрининговых программ, ЕС в сентябре 2015 года запустил проект EU-TOPIA с объемом финансирования 2,9 млн евро. Его задача – создать систему, позволяющую высчитывать и создавать наиболее эффективную модель скрининга для каждой конкретной страны, учитывая показатели заболеваемости, затраты государства на лечение и прочие условия. Над проектом работают университеты семи стран – Голландии, Великобритании, Финляндии, Италии, Словении, Эстонии и Венгрии. Помимо колоректального рака, EU-TOPIA должна разработать алгоритмы для формирования скрининговых сценариев для определения риска злокачественных новообразований молочной железы и шейки матки. Суммарно от трех этих онкозаболеваний в ЕС ежегодно умирают около 250 тысяч человек, что составляет 20% в общей структуре онкологической смертности. Работа над EU-TOPIA должна завершиться к 2020 году, а к 2025-му авторы ждут практических результатов: сокращения доли гипердиагностики и смертности, увеличения показателя добавленных лет жизни (life years gained) и экономической эффективности программ.
ТЕСТ ИМЕЕМ
«После 50 лет начинается экспоненциальный рост колоректального рака. Но 95% случаев рака кишечника, как и рака шейки матки, профилактируемы», – настаивает Бадма Башанкаев из GMS Clinic. При этом Россию нельзя причислить ни к одному из скрининговых «лагерей». В нормативных документах, казалось бы, прописаны и покрываются тарифами системы ОМС все необходимые тесты. В частности, приказ Минздрава от февраля 2015 года №36ан «Об утверждении порядка проведения диспансеризации определенных групп взрослого населения» обязывает проводить гражданам в возрасте от 48 до 75 лет иммунохимические тесты на скрытую кровь, хотя и допускает проведение гваяковой пробы (гемокульт-теста). При подозрении на онкозаболевание на втором этапе диспансеризации хирург или проктолог может назначить колоноскопию или ректороманоскопию (позволяет обследовать только прямую кишку и дистальный отдел сигмовидной кишки). «Здесь загвоздка: какие тесты используются? Должны быть именно иммунохимические, но зачастую «на борту» медучреждений старые тесты плохого качества. Дальше, если тест положительный, пациента направляют к колопроктологу или хирургу на обследование, чтобы они выяснили причину: например, у пациента геморрой, – описывает отечественную модель Башанкаев. – Если дело серьезнее, пациента направляют на колоноскопию. В нашей ситуации правильно дать право терапевтам отправлять пациентов на колоноскопию сразу после положительного теста».
В январе 2017 года Минздрав вынес на общественное обсуждение обновленный проект порядка проведения диспансеризации. В нем требования к анализу на скрытую кровь ужесточены – допускается использование только иммунохимических тестов, которые должны проводиться один раз в два года для граждан от 49 до 74 лет. На втором этапе диспансеризации в проекте приказа в качестве дополнительного обследования фигурирует только колоноскопия.
Заболеваемость колоректальным раком в России
«В действующем приказе обследования уже прописаны хорошо, пока не принятый апдейт – просто идеальные рекомендации, именно такие, какие нужны», – замечает Антон Барчук из питерского НИИ онкологии. Парадокс в том, что, несмотря на грамотно прописанные нормативы, скрининг по-прежнему не организован. Подтверждение тому – эпидемические данные: злокачественные новообразования в ободочной кишке на III и IV стадиях, согласно последнему отчету МНИОИ им. П.А. Герцена, выявлены у 54% пациентов; опухоли прямой кишки III и IV стадий – у 49% больных. Опрошенные Vademecum онкологи соглашаются, что порядки прохождения диспансеризации и профосмотров в части выявления рака кишечника – рабочие, загвоздка – в их исполнении.
«Каждый проект скрининга для одной локализации запускается долго и мучительно, требует отдельной пристальной работы, планирования и контроля. У нас выпустили приказ, и подразумевается, что все начнут по нему работать, но, конечно, этого не происходит», – констатирует Барчук. Этот тезис подтверждают данные ГНЦК им. Рыжих – в федеральном лечебном центре подсчитали, что в 2016 году в России было проведено не более 2 тысяч «скрининговых» колоноскопий (хотя общее количество выполненных исследований составило 900 тысяч). При этом на первом этапе диспансеризации было выявлено около 90 тысяч человек с анемиями – среди этого числа есть потенциальные пациенты проктологов, однако на дальнейшее обследование это люди направлены не были. «Выявили анемию, а причины дефицита гемоглобина не рассматривали, но там может быть скрытая кровопотеря из-за колоректального рака, рака желудка, язвенного колита, болезни Крона. Это подпул пациентов, и если не колоноскопию, то хотя бы сигмоскопию нужно сделать», – указывает на проблему руководитель отдела развития колопроктологии ГНЦК им. А.Н. Рыжих Алексей Веселов.
В среднем расходы на второй этап диспансеризации в зависимости от региона колеблются в пределах 2-3 тысяч рублей, в то время как затраты на проведение колоноскопии составляют 3-4 тысячи рублей. «Если второй этап диспансеризации не покрывает расходы на исследование, пациента можно вести по законченному случаю, дневному стационару или как пациента с диагнозом», – предлагает варианты Веселов. В одном из административных округов Москвы сотрудники ГНЦК открыли эндоскопический кабинет, чтобы восполнить дефицит специалистов. «И врачи поликлиник направляют к нам бабушек с запорами, а не пациентов с анемиями. Как будто саботируют, – сокрушается Веселов. – У человека анемия, терапевт назначает ему препараты железа, но не ищет источник кровотечения, не направляет на онкопоиск.. По мнению Веселова, нужны отдельные образовательные мероприятия для терапевтов и врачей общей практики, по итогу которых будут сформированы инструкции для персонала поликлиник.
По словам Антона Барчука, необходимо создать структуру, которая будет контролировать количество и качество выполняемых исследований, аккумулировать и обрабатывать данныеоб исходах – у какой доли обследованных развился или не развился рак, выявлять дефекты модели скрининга и совершенствовать ее. В Норвегии и Финляндии, например, эти задачи решают национальные канцер-регистры: ведущие их специалисты планируют и разрабатывают проекты скрининга, исполняемые затем муниципалитетами. Работа с популяцией и техническое оснащение в финском канцер-регистре финансируются за государственный счет, а большая часть профильных научных исследований спонсируются Финским раковым обществом, одной из крупнейших по объемам собираемых пожертвований НКО в стране.
Но каким бы образом – с помощью гваяковой пробы, иммунохимического теста, сигмоскопии или виртуальной колоноскопии – не был обследован пациент, при подозрительном результате в конечном итоге все оказывается завязано на колоноскопии, поскольку это единственный метод, позволяющий получить образцы тканей для биопсии и удалить обнаруженные полипы.
И потому, единогласно заявляют эксперты, запускать масштабные скрининговые проекты можно только удостоверившись, что ресурс эндоскопической службы адекватен поставленной задаче. «Колоноскопия – не то исследование, которое можно выполнить дважды, потому что первое было сделано некачественно. Даже при скрининге рака шейки матки цитологию можно переделать безболезненно для женщины, – объясняет Антон Барчук. – Поэтому при популяционных программах колоноскописты должны быть в состоянии качественно выполнять большое количество исследований».
Именно поэтому те же британцы еще до старта своей скрининговой программы разработали систему контроля качества, обеспечивающую примерно одинаковый уровень диагностики повсеместно: запустили рейтинг эндоскопистов с оценкой количества выполняемых ими исследований, затраченного на процедуру времени и доли пациентов с выявленными полипами.
«Специалист должен делать много колоноскопий, и важен процент найденных и удаленных полипов. Если, например, из 100 человек колоноскопист находит полипы у 10 – значит что-то не так, он должен их находить у 30 человек минимум, – поясняет алгоритмы британской модели Барчук. – Кроме этого, нужны независимые системы фиксации времени процедуры. Нужно пройти всю кишку до конца и вернуться – это важно, но так делают не все специалисты. Ну а России для начала требуются хотя бы современные колоноскопы».
МАРШРУТНЫЕ ТИСКИ
Устаревшее оборудование, слабые компетенции операторов превращают красиво описанную нормативами трехступенчатую систему оказания медпомощи в насмешку над здравым смыслом и пациентами. «Вот врач в поликлинике, у него нет расходников, нет качественного колоноскопа, а есть старый прибор без необходимых сегодня фукциональных опций. У него нет нужных знаний и навыков. Он увидел полипы и отправляет пациента в онкодиспансер, чтобы сделать пациенту колоноскопию на экспертном уровне», – приводит типичный пример маршрутизации больных руководитель направления «Хирургия» Olympus по России и СНГ Роман Комаров.
Но и в диспансеры пациенты часто поступают недообследованными и без необходимого набора анализов, что делает плановую госпитализацию невозможной. Больной вынужден либо остаться и проходить платное обследование, либо возвращаться к месту жительства, чтобы бесплатно дособирать анализы, а заодно дождаться своей очереди на госпитализацию. «Пациент может жить в другом городе, – продолжает описание мытарств среднестатистического россиянина с подозрением на рак кишечника Комаров. – Он не планировал ни время, ни деньги на то, чтобы остаться на три-четыре дня в другом городе, он уезжает обратно «дообследоваться», и к тому времени, как он попадет к грамотному эксперту, время может быть упущено».
Онкологи в один голос говорят о необходимости мультидисциплинарной команды, задействованной в диагностике и терапии. Но подобных сработанных профильных команд в российских клиниках по-прежнему немного. Очаги качественной экспертизы колоректального рака можно пересчитать буквально по пальцам: в РОНЦ им. Н.Н. Блохина работает отделение во главе с Арсеном Расуловым; в НИИ онкологии им. Н.Н. Петрова такую команду тщательно собирал Алексей Карачун, в московской 62-й больнице – Павел Кононец. «Такие больные зачастую попадают в отделения хирургии с непроходимостью – это экстренная операция – и только потом к онкологам. Самый неприятный вариант, когда пациент приходит, уже где-то прооперированный», – говорит бывший главврач 62-й больницы, а сейчас руководитель онкокластера «Медси» Анатолий Махсон.
Пациенты с онкозаболеваниями кишечника должны получать помощь исключительно в специализированных медучреждениях, настаивают эксперты. «Например, при опухоли кишки есть специальные тесты на микросателлитную нестабильность – тогда можно применять иммунные препараты, но об этом знают люди, занимающиеся проблемой прицельно, – приводит примеры клинических случаев Махсон. – При опухоли в нижних ампулярных отделах очень важно начинать с неоадъювантной химиолучевой терапии, поскольку процент рецидивов очень высок. Или вот вопрос: правая половина толстой кишки, большая опухоль, нет угрозы непроходимости. Ты прооперируешь, пациент домой не успеет уйти, как вся печень будет засыпана. Поэтому неоадъювантная терапия зачастую определяет чувствительность опухоли. Тогда проводится несколько циклов, потом операция, затем продолжение химиотерапии, потом химиоэмболизация печени».
Отдельный вопрос – тарификация затрат на оказание помощи при онкозаболеваниях кишечника. «Стоимость лапароскопических операций, легче переносимых пациентами, не проходит по тарифам ОМС, она не проходит даже по ВМП, включенной в ОМС. В 62-й больнице мы в свое время создали систему, учитывающую все расходники, использующиеся во время операции, – вспоминает Анатолий Махсон. – Только на расходные материалы – клипаторы, сшивающие аппараты и так далее – при эндоскопических абдоминальных операциях тратится 150–240 тысяч рублей. А ВМП по ОМС была 110 тысяч рублей».
Финансовое обеспечение медпомощи при колоректальном раке по программе госгарантий в 2017 году